کربوکسیلیک اسید: آشنایی با ترکیب شیمیایی و کاربردهای آن
محمد ۹ ماه پیش
کربوکسیلیک اسیدها یک دسته از ترکیب های آلی هستند که مشخصه اصلی آن ها وجود یک یا چند گروه عاملی کربوکسیل «COOH» در ساختار مولکولی آن هاست. این گروه های عاملی کربوکسیل در واقع شامل یک اتم کربن متصل به یک گروه هیدروکسیل (OH) و یک اتم اکسیژن دوگانه بوده و به عنوان یک گروه عاملی قطبی در این ترکیب های آلی ظاهر می شوند. کربوکسیلیک اسیدها به دلیل وجود این گروه های عاملی، دارای خواص و کاربردهای شیمیایی متنوعی هستند.
زیرنویس: آشنایی با کربوکسیلیک اسید
کربوکسیلیک اسیدها دسته ای از ترکیبات آلی هستند که در آنها یک یا چند گروه عاملی کربوکسیل «COOH-» وجود دارد. متانوییک اسید HCOOH ساده ترین و اتانوییک اسید CH3COOH آشناترین آنهاست. کربوکسیلیک اسیدهای سبک (حداکثر تا چهار اتم کربن) به خوبی در آب حل می شوند، اما با افزایش طول زنجیره کربنی، انحلال پذیری آنها در آب کاهش می یابد، به طوری که بسیاری از آنها در عمل در آب نامحلول هستند. کربوکسیلیک اسیدها اسیدهای ضعیفی هستند و با حل شدن در آب، تعدادی از مولکول های آنها پروتون اسیدی خود را به مولکول های آب می دهند و به سرعت به حالت تعادل می رسند. این اسیدها یک، دو یا چند عاملی هستند که به اسیدهای آلی چند عاملی پلی الکترولیک گفته می شوند.
اسیدها در انواع قوی و ضعیف دسته بندی می شوند، این یعنی اسیدها دارای قدرت های متفاوتی نسبت به یکدیگر هستند که برای انجام آزمایشات و مطالعات گوناگون پیرامون آن ها لازم است بتوانیم قدرتشان را با یکدیگر مقایسه کنیم. حال با یکی دیگر از اسیدهای ضعیف به نام کربوکسیلیک اسید آشنا می شویم. کربوکسیلیک اسیدها اسیدهای ضعیفی هستند و بر اثر حل شدن در آب تعدادی از مولکول های آنها پروتون اسیدی خود را به مولکول های آب می دهند و به سرعت به حالت تعادل می رسند.
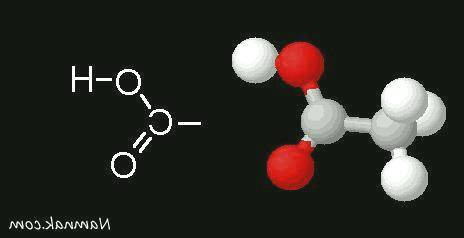
آشنایی با کربوکسیلیک اسید
نام اسیدهای کربوکسیلی از ماده یا منبعی که به دست آمده اند، گرفته شده است. در نامگذاری معمولی جهت مشخص کردن محل استخلاف ها از α و β و γ و ... استفاده شده در این روش، اولین کربن متصل به عامل اسیدی α و دومی β و... می باشد. • CH3COOH:استیک اسید • HCOOH:فرمیک اسید • PhCOOH:بنزوئیک اسید برای نام گذاری رسمی، ابتدا طولانی ترین زنجیری را که عامل اسیدی روی آن قرار گرفته، مشخص می کنند و شمارش را از سمت عامل اسیدی انجام می دهند. بعد از مشخص کردن استخلاف ها و محل آنها، نام زنجیره اصلی را قید می کنند و سپس به آخر آن، پسوند اوئیک (oic) اضافه می کنند. اگر زنجیره دارای پیوند دوگانه باشد، ذکر نوع ایزومر هندسی نیز لازم است.
خصلت اسیدیکربوکسیلیک اسید
اگرچه اسیدهای کربوکسیلیک در مقایسه با اسیدهای معدنی مثل اسید سولفوریک و اسید کلریدریک و اسید نیتریک بسیار ضعیف هستند، ولی در هر صورت، در مقایسه با الکل ها، آب، آمونیاک و استیلن ها از اسیدیته قوی تری برخوردار هستند. اسیدیته اسیدهای آلی به ساختمان اسید و طبیعت عوامل و گروه های موجود در روی آلکیل یا آریل بستگی دارد. مثلا تری کلرو استیک اسید حدود 15×103 بار قوی تر از استیک اسید می باشد. این اسیدیته زیاد و قابل ملاحظه به خاصیت الکترون گیری هالوژن، مربوط می باشد. بطور کلی، گروه های گیرنده الکترون، قدرت اسیدی را افزایش داده و برعکس گروه های دهنده، موجب ضعیف شدن اسیدیته می شوند.
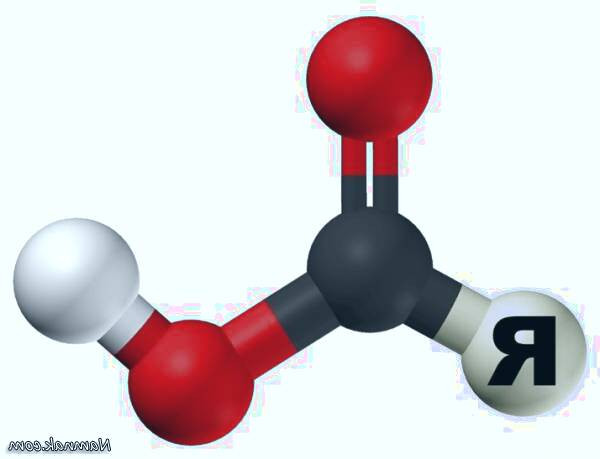
آشنایی با کربوکسیلیک اسید
روش تهیه کربوکسیلیکاسید
در بین اسیدهای کربوکسیلیک، از اسید استیک زیاد استفاده می شود و این ماده به روش صنعتی و از اکسید شدن آلدئید استیک یا هیدروکربن ها و یا از واکنش متانل با منوکسید کربن در حضور کاتالیزور (رودیم- ید) بدست می آید. بخش عمده اسید استیک که به عنوان سرکه (محلول رقیق اسید استیک در آب) مصرف می شود، از اکسید شدن اتانول به وسیله آنزیم ها در شرایط هوازی (در حضور اکسیژن) تهیه می شود. یکی از منابع مهم تهیه اسیدهای کربوکسیلیک، منابع گیاهی و حیوانی می باشد. از استرهای به دست آمده از منابع ذکر شده، اسیدهای 6 تا 18 کربنی با درجه خلوص بالا به دست می آید. برای تهیه اسیدهای آروماتیک مانند اسید بنزوئیک و یا اسید فتالیک در مقیاس صنعتی، از روش اکسید شدن استفاده می شود. در این روش، تولوئن و گزیلن تولید شده از واکنش های Reforming به وسیله اکسید کننده های مناسب اکسید می شود. اکسید کردن آلکیل بنزن، مشکل تر از اکسید کردن اولفین ها می باشد و لذا فرایند اکسید کردن با استفاده از حرارت انجام داده می شود. آلکیل بنزن ها از طریق هالوژن دار شدن و هیدرولیز هم به اسید مربوط تبدیل می شوند.
نکته: - اسیدهای کربوکسیلی اسیدهای ضعیفی می باشند که با افزایش تعداد کربن در آنها قدرت اسیدیشان کاهش پیدا می کند. - هر عاملی که روی پایداری و میزان بار منفی باز مزدوج این اسیدها تأثیر گذارد روی قدرت اسیدی این مواد نیز تاثیر دارد. - شاخه های الکترون دهنده مانند شاخه های هیدروکربنی (متیل، اتیل و ...) به دلیل افزایش بار منفی باز مزدج حاصل از این - اسیدها، باز مزدوج این اسیدها را ناپایدار کرده تا واکنش برگشت تفکیک این اسیدها بهتر انجام شود و باعث کاهش قدرت بازی این اسیدها نیز می گردد. - الکترون گیرنده ها مانند هالوژن ها، اکسیژن و غیره به دلیل کاهش تراکم بار منفی باز مزدوج این اسیدها، باز مزدوج این اسیدها را پایدار کرده باعث افزایش قدرت بازی می شوند. - هرچه الکترونگاتیوی هالوژن بیشتر و تعداد آنها بیشتر باشد قدرت اسیدی کربوکسیلیک اسیدها بیشتر است. - هر چه تعداد شاخه ها بیشتر و فاصله آنها تا عامل کربوکسیل نزدیک تر باشد اثر شاخه ها روی قدرت اسیدی (کاهش یا افزایش) بیشتر می باشد. جهت شناسایی کربوکسیلیک اسیدها یکسری روش های شیمیایی و یک سری اسپکتروسکوپی وجود دارد. تعدادی از اسیدهای یک، دو یا چند عاملی که اسیدهای آلی چند عاملی پلی الکترولیک گفته می شود: